Introdução
No Brasil, o câncer colorretal (CCR) é o terceiro mais comum. Estimavam-se, para o ano de 2020, 17.760 novos casos em homens (7,9%) e 20.470 em mulheres (9,2%)(INCA, 2020). Considerando esses números, o CCR é o segundo tipo de câncer mais frequente nas mulheres e o terceiro na população masculina, excluindo-se os casos de tumores de pele não melanoma.
No passado, as lesões serrilhadas eram classificadas como pólipos hiperplásicos e sem potencial de malignização (Rex et al., 2012). Atualmente, estima-se que a via serrilhada de carcinogênese é responsável por cerca de 20 a 30% dos casos de CCR. Este dado nos mostra a importância de conhecermos melhor tais lesões, pois, em números absolutos, representa um impacto maior que outros tumores do aparelho digestivo, como as neoplasias de estômago e pâncreas (Rex et al., 2012; Crockett et al., 2015; Siegel et al., 2017).
Características das lesões sésseis serrilhada
As lesões sésseis serrilhadas (LSS) apresentam características clínicas, genéticas e histológicas distintas dos adenomas. Por tal motivo, a Organização Mundial de Saúde (OMS) alterou a nomenclatura da classificação dos pólipos e lesões serrilhadas. Atualmente, são aceitas as seguintes nomenclaturas: Pólipo hiperplásico (PH); Pólipo hiperplásico tipo microvesicular; Pólipo hiperplásico tipo rico em células caliciformes; Lesões sésseis serrilhadas (LSS); Lesões sésseis serrilhadas com displasia (LLSD); Adenoma serrilhado tradicional (AST) e Adenomas serrilhados não classificáveis, estes incluem os adenomas tubulovilosos serrilhados, recentemente descritos (WHO, 2019).
Epidemiologia
- As LSSs representam cerca de 10% dos pólipos cólicos;
- São mais comuns em idosos, mas a idade não parece ser um fator tão influenciador quanto nos adenomas convencionais;
- São mais prevalentes em caucasianos e, discretamente, mais comuns em mulheres;
- Tabaco, álcool e IMC alto foram relacionados com aumento do risco para LSSs;
- Já o uso de anti-inflamatório não esteroidal, dieta rica em folato, cálcio e fibras foram relacionados como fatores de proteção (Crockett 2014; O’Connell e Crockett, 2017).
Características endoscópicas
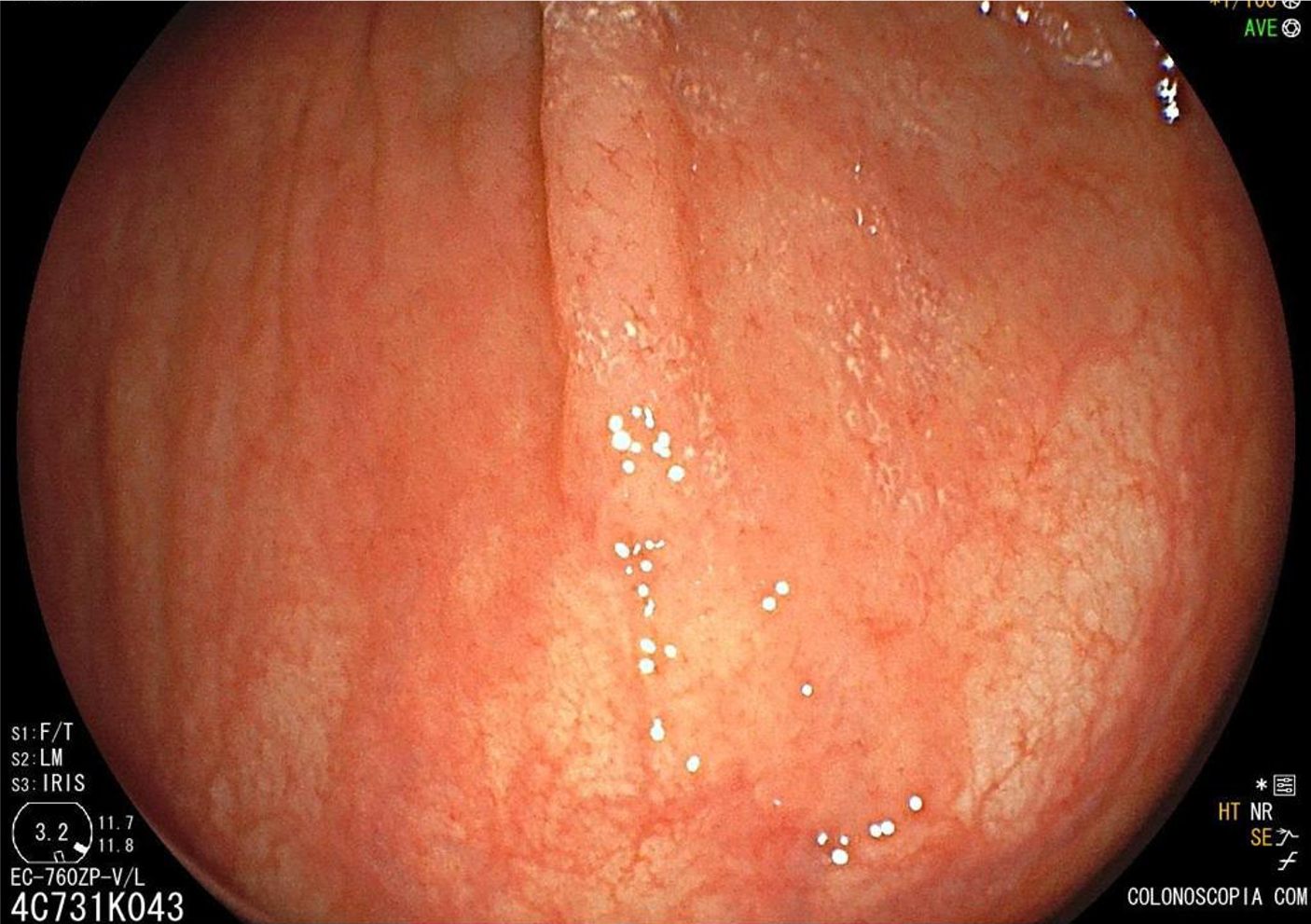
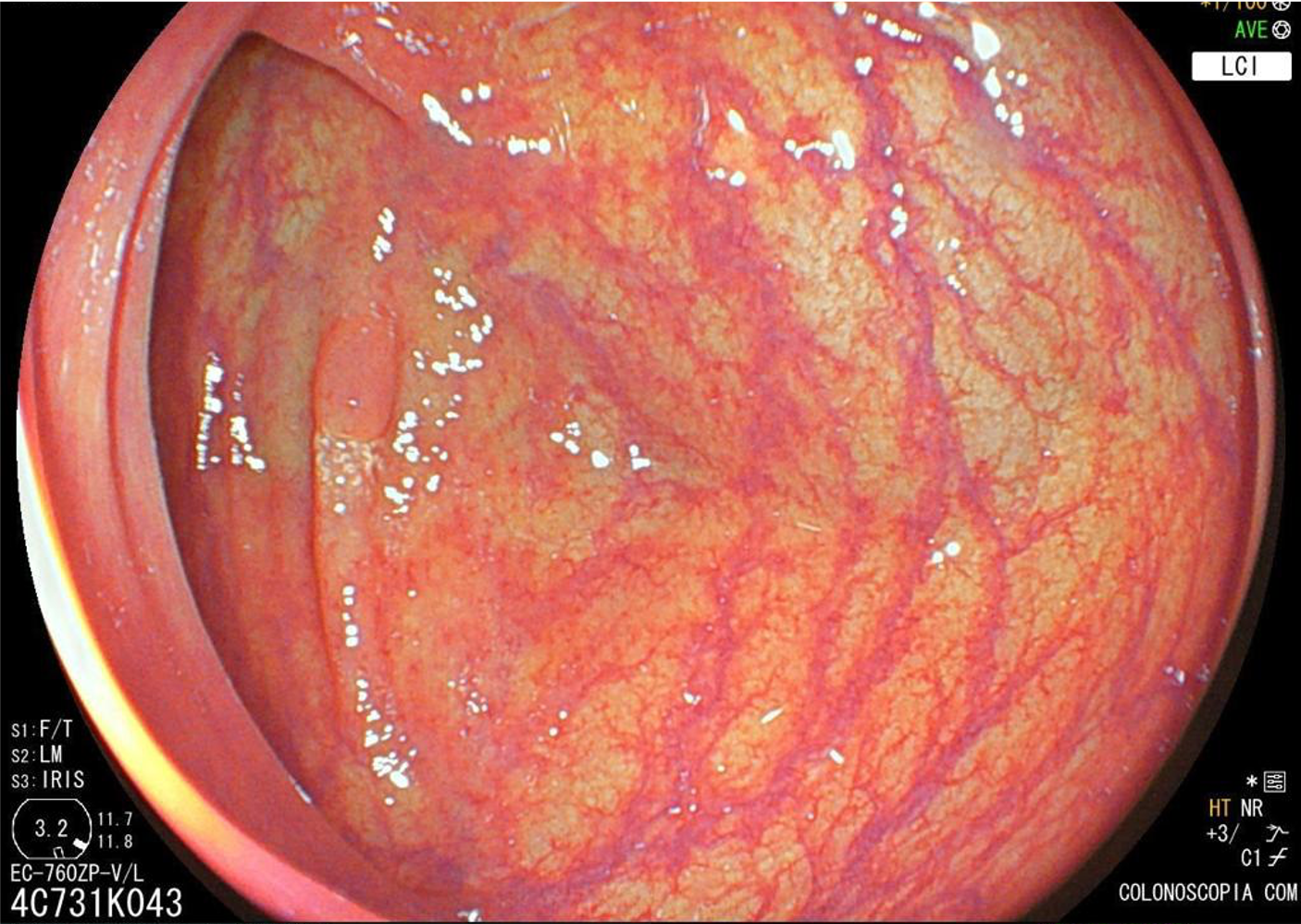
Localizam-se mais comumente no cólon proximal (70-80%), apresentam morfologia plana, principalmente durante a insuflação do cólon, e coloração semelhante à da mucosa normal, dificultando o seu diagnóstico e tratamento endoscópico (Pohl et al., 2013; Crockett et al., 2015).
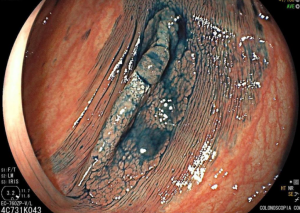
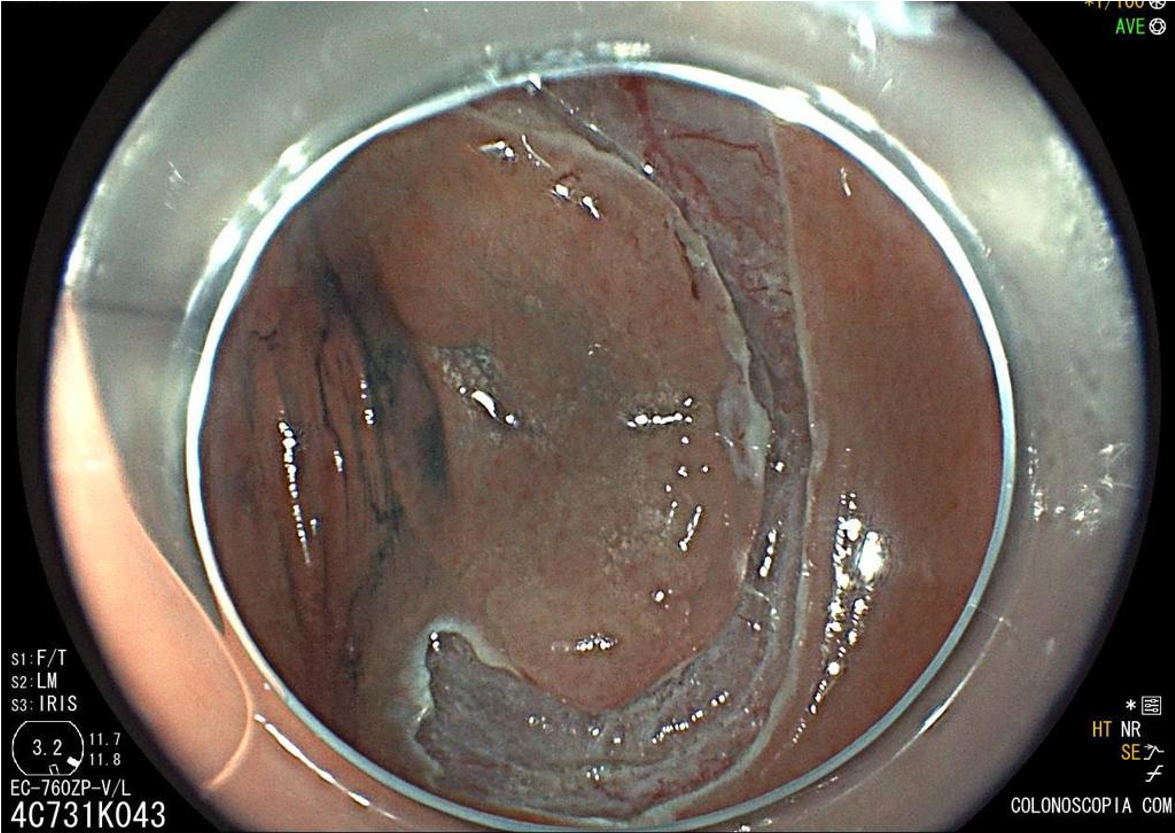
Cromoscopia com índigo.
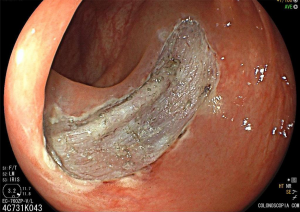
Pós-ressecção por ESD.
Etiopatogenia
As LSSs estão relacionadas a uma via alternativa de carcinogênese, descrita há pouco mais de 15 anos.
A LSS pathway se caracteriza pela mutação do oncogene BRAF como evento inicial (70-80%) que pode ocorrer na mucosa normal ou em um pólipo hiperplásico tipo microvesicular.
Posteriormente, ocorre hipermetilação das ilhas CpG (regiões do genoma ricas em CpG ou Citosina – Phosfato – Guanina) nas regiões promotoras de genes supressores de tumor (CIMP). Consequentemente, ocorre o silenciamento desses genes (MGMT, MLH1, p16, MINT1, MINT2 ou MINT31) em 70-76% das lesões. CIMP pode ser alto (quando mais de dois genes são metilados), baixo ou ausente.
A progressão para displasia e câncer invasivo acontece por metilação dos genes de reparo do DNA (MLH1, MSH2, MSH6 e PMS2), levando à instabilidade de microssatélites (MSI), normalmente numa velocidade mais rápida que a via adenoma-carcinoma. (WHO, 2019; Patai et al., 2013) (Figura 1).
Diferentemente das LSSs, os ASTs se apresentam predominantemente na forma polipóide e localizados no cólon distal e reto em 70% dos casos. A carcinogênese também difere, ocorrendo a mutação KRAS, primariamente, a partir da mucosa normal ou de pólipo hiperplásico rico em células caliciformes, seguida de supressão do p53 nas lesões que evoluem para displasia de alto grau e/ou carcinoma (WHO, 2019).
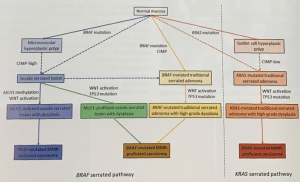
Figura 1. Carcinogênese das lesões serrilhadas. Fonte: WHO, 2019
Diagnóstico
A colonoscopia é considerada menos efetiva na prevenção do CCR no cólon proximal quando comparada ao cólon distal (Nishihara et al., 2013). Fato que pode ser constatado observando os tumores denominados de intervalo, diagnosticados após um exame de rastreamento negativo. Eles, na sua maioria, apresentam características moleculares semelhantes às LSSs (Le Clercq e Sanduleanu, 2014).
Com os avanços tecnológicos, a qualidade da imagem dos exames endoscópicos permite um maior número de lesões diagnosticadas e um melhor estudo da superfície das mesmas, principalmente quando é possível utilizar magnificação de imagem e cromoscopia eletrônica e/ou convencional. Foi estudando a superfície das lesões que surgiu a classificação de Kudo. Ela prevê cinco tipos de abertura de criptas, sendo um deles, o tipo II, característico dos pólipos hiperplásicos, mas este não os difere das LSSs.
Em 2012, Kimura et al. publicaram um novo padrão de cripta para identificar as lesões precursoras originárias de LSSs e o subclassificaram como tipo II-O (Figura 2). O estudo mostrou que o padrão tipo II-O é altamente preditivo para lesões sésseis serrilhadas com sensibilidade de 65.5% e especificidade de 97.3%. A identificação do tipo II-O também mostrou significante relação com a presença de mutação BRAF e CIMP positivo [OR (IC 95 %) 39.3 (9.9 – 155.7); 32.1 (9.1 – 113.1)], mostrando-se ser um importante achado de lesões com risco de malignização e que precisam ser tratadas (Kimura et al., 2012).
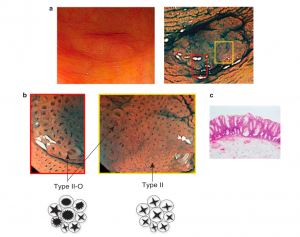
Figura 1. Carcinogênese das lesões serrilhadas. Fonte: WHO, 2019
A taxa de detecção de lesões neoplásicas é um índice de qualidade da colonoscopia, para as LSSs os números ainda são bem variáveis, mas a sociedade britânica de gastroenterologia recomenda que essa taxa seja de pelo menos 5% em paciente com indicação de realização do exame para rastreamento (East et al., 2017).
Os guidelines ocidentais recomendam que qualquer lesão serrilhada proximal ao ângulo esplênico deve ser ressecada, diferentemente de lesões com características hiperplásicas no sigmoide e reto. No Japão, a conduta nas lesões serrilhadas é variável de acordo com a instituição, mas a indicação de ressecção é baseada no exame minucioso da superfície com cromoscopia e magnificação (Tanaka et al., 2020).
Tratamento endoscópico
As LSSs menores que 10 mm devem ser tratadas sem eletrocautério, realizando-se ressecção a frio (RAF). A RAF é superior à ressecção com pinça para o tratamento de pequenos pólipos, pois é possível garantir margens, devendo-se incluir na apreensão 1 a 2 mm de mucosa normal (Ma et al., 2017).
As LSSs maiores que 10 mm devem ser tratadas como primeira opção por meio da mucosectomia (endoscopic mucosal resection – EMR) em fragmento único ou piecemeal, apesar de, nos últimos anos, alguns trabalhos mostrarem a mucosectomia a frio como uma boa opção (Ma et al., 2017; Kaltenbach et al., 2020).
Em lesões ≥ 20 mm, a EMR possui baixo risco de complicação (1%) e recorrência local (14%), como Hassan et al. evidenciaram em revisão sistemática (Hassan et al. 2016). A desvantagem da EMR piecemeal está na limitação da avaliação histológica, pois não é possível a avaliação de margens laterais, além de uma maior taxa de recidiva local em relação às ressecções em monobloco. (Okamoto et al., 2016).
Pohl et al. mostraram que a taxa de ressecção incompleta das LSSs foi quatro vezes maior que os adenomas (31.0% vs 7.2%; P ≤ 0.001), e lesões que mediam entre 10 e 20 mm foram tratadas de forma incompleta em 47,6%, possivelmente devido à localização, morfologia e dificuldade de avaliação de sua bordas (Pohl et al., 2013).
No entanto, os trabalhos mais recentes mostram uma baixa taxa recorrência de 3.6% (95% CI, 0.5%– 6.7%) para lesões ≥ 10 mm e de 7-8.7% para ≥ 20 mm com a utilização da técnica clássica de EMR (Kaltenbach et al., 2020).
Lesões neoplásicas com características de alto grau e/ou presença de fibrose são indicações de ressecção em monobloco por dissecção endoscópica da submucosa (endoscopic submucosal dissection – ESD) (Tanaka et al., 2020). Uma alternativa à ESD, nesses casos, pode ser a EMR underwater, visto que aumenta as chances de ressecção em fragmento único (Binmoeller et al., 2015). No entanto, tais técnicas apresentam um maior potencial de complicações, como perfuração e sangramento, quando comparados à EMR clássica e devem ser executadas em centros de referência (Saito et al., 2010; Tanaka et al., 2015b; Binmoeller et al., 2015).
Vigilância
O acompanhamento após ressecção de LSSs ainda possui divergências e pouca evidência científica, mas a orientação das sociedades americanas, US Society Task Force, publicada em 2020, está resumida na tabela abaixo (Tabela 1).
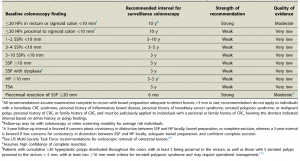
Tabela 1. Recomendação para seguimento com colonoscopia após polipectomia de PHs, LSSs e ASTs. Fonte: Gupta et al. 2020.
Como citar esse artigo:
Mello, BB. Lesões Sésseis Serrilhadas. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/lesoes-sesseis-serrilhadas
Referências
- INCA Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Estatísticas do câncer. 2020. Disponível: https://www.inca.gov.br/numeros-de-cancer
- Crockett SD, Snover DC, Ahnen DJ, Baron JA. Sessile Serrated Adenomas: An Evidence-Based Guide to Management. Clin Gastroenterol Hepatol 2015;13:11-26.
- East JE, Atkin WS, Bateman AC, Clark SK, Dolwani S, Ket SN, Leedham SJ, Phull PS, Rutter MD, Shepherd NA, Tomlinson I, Rees CJ. British Society of Gastroenterology position statement on serrated polyps in the colon and rectum. Gut. 2017 Jul;66(7):1181-1196.
- Gupta S, Lieberman D, Anderson JC, Burke CA, Dominitz JA et al. Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastrointestinal Endoscopy 2020;91: 463-485.
- Hassan C, Repici A, Sharma P, et al. Efficacy and safety of endoscopic resection of large colorectal polyps: a systematic review and meta- analysis. Gut 2016;65:806-20.
- Kaltenbach T, Anderson JC, Burke CA, Dominitz JA, Gupta S, Lieberman D, Robertson DJ, Shaukat A, Syngal S, Rex DK. Endoscopic Removal of Colorectal Lesions Recommendations by the US Multi-Society Task Force on Colorectal Cancer. American Society for Gastrointestinal Endoscopy, AGA Institute, and the American College of Gastroenterology. Gastrointestinal Endoscopy 2020;91: 486-519.
- Kimura T , Yamamoto E , Yamano HO et al. A novel pit pattern identifies the precursor of colorectal cancer derived from sessile serrated adenoma. Am J Gastroenterol 2012 ; 107 : 460 – 9.
- Le Clercq CMC, Sanduleanu S. Interval colorectal cancers: What and why. Curr Gastroenterol Rep. 2014;16(3):375.
- Ma MX, Bourke MJ. Sessile Serrated Adenomas: How to Detect, Characterize and Resect. Gut Liver. 2017 May 11. doi: 10.5009/gnl16523.
- Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med. 2013;369(12):1095-105.
- O’Connell BM, Crockett SD. The clinical impact of serrated colorectal polyps. Clin Epidemiol. 2017, 22;9:113-125.
- Okamoto K, Kitamura S, Kimura T, Nakagawa T, Sogabe M, Miyamoto H, et al. Clinicopathological Characteristics of Serrated Polyps as Precursors to Colorectal Cancer: Current Status and Management. J Gastroenterol Hepatol 2016.
- Patai A V, Molnár B, Tulassay Z, Sipos F. Serrated pathway: alternative route to colorectal cancer. World J Gastroenterol 2013;19(5):607–15.
- Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology. 2013;144(1):74-80.
- Rex DK, Ahnen DJ, Baron JA, Batts KP, Burke CA, Burt RW, Goldblum JR, Guillem JG, Kahi CJ, Kalady MF, O’Brien MJ, Odze RD, Ogino S, Parry S, Snover DC, Torlakovic EE, Wise PE, Young J, Church J. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol 2012; 107:1315-1329.
- Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017; 67:7
- Tanaka S, Kashida H, Saito Y et al. Japan Gastroenterological Endoscopy Society guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Digestive Endoscopy 2020; 32: 219–239.
- WHO Classification of Tumors Editorial Board. Digestive system tumours. Lyon (France): Internacional Agency for Reseach on Cancer; 2019. (WHO classification of tumor series, 5th ed.; vol 1).
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Endoscopista do Hospital Sírio-Libanês, Hospital Alemão Oswaldo Cruz e do Instituto de Câncer Dr. Arnaldo.